A técnica de micropropagação in vitro como estratégia de inovação tecnológica na produção de mudas
Júlio César Parra de Almeida [1]
Fernanda Vaz Dias 2
Plinio Alexandre dos Santos Caetano 3
Resumo
A técnica de micropropagação in vitro é um método sustentável para a produção de mudas de plantas, pois através dela, torna-se possível a reprodução de plantas em laboratório, utilizando células ou tecidos vegetais cultivados em meios específicos, permitindo a obtenção de mudas em maior quantidade, em menor tempo e com maior qualidade. Assim, este artigo tem o intuito de apresentar a técnica de micropropagação in vitro como estratégia de inovação tecnológica na produção de mudas, incluindo a intervenção na instalação de um laboratório para aplicação da técnica, de forma a trazer inovação e gestão sustentável no cultivo de espécies vegetais. Para tanto, a presente pesquisa se originou de uma sólida pesquisa bibliográfica, priorizando os estudos mais atualizados sobre o assunto, contidos em livros e artigos científicos recentes, contribuindo para a produção de conhecimento sobre essa temática. O objetivo do estudo foi investigar as vantagens estratégicas desta técnica, destacando sua capacidade de melhorar a eficiência operacional e agregação de valor, buscando a melhoria contínua, discutindo a importância de um planejamento estratégico sólido para garantir o manejo bem-sucedido. Os resultados esperados foram obtidos através de simulação computacional do crescimento de mudas in vitro, onde optou-se por realizar a simulação em linguagem de programação R, com mudas de orquídeas, bananas e amoras, através de um modelo baseado em parâmetros biológicos e reguladores de crescimento, onde foram incorporadas variáveis como a concentração dos reguladores de crescimento 6-Benzilaminopurina (BAP) e Ácido Naftalenoacético (ANA), o número de subcultivos e a taxa de multiplicação das mudas.
Palavras-chave: Micropropagação in vitro; inovação na micropropagação de mudas; gestão sustentável.
The in vitro micropropagation technique as a technological innovation strategy in seedling production
Abstract
The in vitro micropropagation technique is a sustainable method for plant seedling production, as it enables the reproduction of plants in a laboratory setting using plant cells or tissues cultivated in specific media. This allows for the production of a larger number of seedlings in less time and with higher quality. Thus, this article aims to present the in vitro micropropagation technique as a strategy for technological innovation in seedling production, including the implementation of a laboratory for the application of the technique, in order to promote innovation and sustainable management in the cultivation of plant species.
To achieve this, the research was based on a solid literature review, prioritizing the most up-to-date studies on the subject, found in recent books and scientific articles, thereby contributing to the body of knowledge on this topic. The objective of the study was to investigate the strategic advantages of this technique, highlighting its ability to improve operational efficiency and add value, while aiming for continuous improvement and discussing the importance of a solid strategic plan to ensure successful management.
The expected results were obtained through a computer simulation of in vitro seedling growth. The simulation was carried out using the R programming language, with seedlings of orchids, bananas, and blackberries, based on a model incorporating biological parameters and growth regulators. Variables such as the concentration of the growth regulators 6-Benzylaminopurine (BAP) and Naphthaleneacetic Acid (NAA), the number of subcultures, and the multiplication rate of the seedlings were included.
Keywords: Micropropagation; seedlings; in vitro; innovation.
Recebido em: 08/04/2025
Aceito em: 15/05/2025
Publicado em: 01/7/2025
1 Introdução
Num mundo onde a necessidade de aumentar a produção de alimentos, de forma sustentável e cada vez mais rápida se torna cada vez mais urgente, a aplicação de técnicas de inovação tecnológica na produção de mudas de alimentos é de suma importância, pois proporciona uma agricultura sustentável, onde de acordo com a Food Connection (2023), protege o meio ambiente e conserva os recursos naturais.
De acordo com Kneipp et al. (2024), diante dos inúmeros problemas ambientais e sociais, os negócios precisam coordenar e planejar suas atividades com o intuito de obter retorno financeiro, sem deixar o uso consciente dos recursos naturais de lado.
Deste modo, esta pesquisa teve como objetivo geral de apresentar a técnica de micropropagação de mudas, bem como o objetivo específico de demonstrar seu importante papel na inovação tecnológica de produção de mudas in vitro, contribuindo de forma positiva, tanto economicamente, quanto para a sustentabilidade ambiental.
Assim, através da elaboração deste artigo científico, almejou-se destacar os conceitos atuais acerca de sustentabilidade, meio ambiente e micropropagação de mudas através da clonagem vegetal in vitro, trazendo uma análise da respectiva técnica de clonagem, perspectivas de uso e impactos econômicos, sociais e ambientais gerados, obtidos através de um estudo de caso realizado em um viveiro de mudas.
Este trabalho de pesquisa está alinhado com a Agenda 2030 que, de acordo o Ministério do Desenvolvimento e Assistência Social, Família e Combate à Fome (2024), é um compromisso global construído pelos 193 Estados-membro da ONU - Organização das Nações Unidas, expresso na Resolução 70 da Assembleia Geral das Nações Unidas, de setembro de 2015, intitulada “Transformando o Nosso Mundo: A Agenda 2030 para o Desenvolvimento Sustentável”, o qual estabelece diversas metas de possibilidades para a transformação do modelo de desenvolvimento sustentável no âmbito econômico, social e ambiental, considerando o contexto e as prioridades dos países e localidades.
Assim, esta pesquisa alinhou-se especialmente aos Objetivos de Desenvolvimento Sustentável – ODS 12 (Consumo e produção responsáveis) e ODS 2 (Fome zero e agricultura sustentável), propostos pela Organização das Nações Unidas (2024). Assim, esta pesquisa se aderiu aderiu-se especialmente com os Objetivos de Desenvolvimento Sustentável - ODS 12 – Consumo e produção responsáveis e ODS 2 – Fome zero e agricultura sustentável (Organização das Nações Unidas, 2024).
Ademais, em um cenário global de aumento populacional e escassez de recursos naturais, a produção de alimentos precisa ser intensificada sem comprometer o meio ambiente. Nesse contexto, a micropropagação de mudas in vitro surge como uma ferramenta crucial para uma agricultura sustentável e resiliente, promovendo produção em larga escala de mudas saudáveis e padronizadas, preservação de espécies vegetais de interesse agronômico e ecológico e redução da dependência de métodos tradicionais, mais lentos e menos eficientes.
Da mesma forma, espera-se que este estudo contribua para o avanço do conhecimento científico e prático na área da biotecnologia vegetal, demonstrando que a micropropagação não é apenas uma técnica laboratorial, mas uma solução viável e estratégica frente aos desafios da produção de alimentos, da conservação ambiental e da sustentabilidade econômica. Espera-se ainda estimular a adoção da técnica por viveiros e agricultores.
2 Referencial teórico
De acordo com Moura (2023), a constatação científica de que os problemas ambientais vêm se tornando críticos, tem causado forte impacto na opinião pública, motivo pelo qual o autor defende que ações de melhorias devem ser tomadas, ressaltando, inclusive, que tais ações são interessantes para se reduzir as marcas deixadas pelos homens e empresas no planeta, a chamada pegada ecológica.
Ainda de acordo com Moura (2023), grandes avanços podem ser obtidos aplicando-se técnicas gerenciais, realizando modificações em procedimentos e condutas de pessoas, criando assim, vantagens competitivas para as organizações, que além de atender as necessidades de seus consumidores, manterá seu objetivo principal, ou seja, os três pilares, ou tripé da sustentabilidade, o qual compreende não apenas o resultado econômico, mas também a qualidade ambiental e a responsabilidade social, garantindo assim, a própria existência da empresa a longo prazo.
Dias (2024), a seu turno, explica que a inovação sempre foi indispensável e continuará sendo para o desenvolvimento e o progresso de qualquer nação, de modo que, durante muito tempo a sociedade associou a ideia de inovação com as Revoluções Industriais. Embora o conceito de inovação não seja, em absoluto, recente, por décadas passou a ser estudado e está frequentemente relacionado com competitividade, onde muitos defendem que a inovação é um “catalisador” da competitividade. Dentro deste conceito, há inúmeras vantagens de se utilizar a inovação associada à agregação de valor, de forma a obter melhores produtos, serviços e processos, gerando economia competitiva e cada vez mais sustentável.
Schumpeter (1997, apud Kneipp et al., 2024), definiu a inovação como um dos motores da economia capitalista, ao descrever a “destruição criadora” como o processo de substituição de bens, produtos, processos e serviços antigos por novas técnicas, sob a perspectiva econômica e empresarial, por meio da criação de valor, formulando um modelo de negócios bem definido.
2.1 Os três pilares da sustentabilidade e os objetivos da Organização das Nações Unidas.
Conforme aponta Alves (2023), a relação entre as dimensões econômica, ambiental e social, ganhou destaque no modelo tripé da sustentabilidade, formulado pelo pesquisador e escritor John Elkington, já em meados da década de 1990 e na esteira dos acontecimentos da Rio-92, conferência mundial do meio ambiente promovida pelas Organização das Nações Unidas (ONU) e realizada na cidade brasileira do Rio de Janeiro. O autor explica ainda que, no ano de 2015, foram propostos pela ONU os 17 Objetivos de Desenvolvimento Sustentável (ODS), os quais compõe a Agenda 2030 e norteiam os compromissos para o desenvolvimento sustentável; os quais foram ampliados após o desenvolvimento dos Objetivos para o Desenvolvimento do Milênio (ODM).
A Organização das Nações Unidas (2024) define, no ODS 2, a ideia de fome zero e agricultura sustentável, onde no subitem 2.3, tem como meta até o ano de 2030, dobrar a produtividade agrícola e a renda dos pequenos produtores de alimentos, com foco nos produtores familiares, inclusive por meio de acesso à recursos produtivos e conhecimento. Além disto, no objetivo número 12 a ideia do consumo e produção responsáveis.
Em uma breve análise do cenário da produção de alimentos no mundo, ainda de acordo com a Organização das Nações Unidas (2023), o relatório do Panorama Regional da Segurança Alimentar e Nutrição 2023 alertou que 6,5% da população da América Latina e do Caribe sofrem de fome, onde os níveis da região continuam mais elevados do que em 2019, antes da pandemia da COVID-19, demonstrando distanciamento das metas previstas no ODS para o ano de 2030. Ainda de acordo com a Organização das Nações Unidas (2023), a região possui o custo mais alto de uma alimentação saudável do mundo, onde o custo aumentou 5,3%.
2.2 Técnicas sustentáveis de produção vegetal
Atualmente existem diversas técnicas sustentáveis de produção vegetal, como por exemplo, as agroflorestas, rotação de culturas, controle biológico de pragas, dentre outras. Nesse sentido, compete apontar que os avanços da biotecnologia trouxeram benefícios significativos para o cultivo de plantas, onde podemos observar que, hoje, graças às técnicas de cultura de tecidos, é possível realizar a propagação de plantas em laboratório. De acordo com Hussain et. al. (2012), a cultura de tecidos vegetais é uma técnica biotecnológica que permite o crescimento e multiplicação de células, tecidos ou órgãos de plantas em condições controladas de laboratório.
Ainda de acordo com Hussain et. al, de forma inovadora, a micropropagação é uma das principais técnicas da cultura de tecidos vegetais, haja vista que ela permite a obtenção de muitos indivíduos geneticamente idênticos em um período relativamente curto. Essa técnica, então, permite o crescimento e multiplicação de células, tecidos, órgãos ou partes de órgãos de uma planta, explante, sobre um meio nutritivo e em condições assépticas e ambientais, tais como iluminação e temperatura controladas, possibilitando a reprodução fiel das características da planta mãe. Essa técnica não apenas aumenta a eficiência na produção, mas também garante a uniformidade genética das plantas cultivadas.
Ademais, a referida técnica se baseia no aproveitamento da totipotência, que de acordo Silva (2021), é a capacidade das células regenerar um organismo completo e diferenciado, mantendo as características fenotípicas da planta original.
De acordo com Carvalho, Silva e Lacerda e Medeiros (2006), entre as vantagens desta técnica em relação a propagação convencional, destaca-se a capacidade de gerar várias plantas a partir de um único explante; espaço reduzido e otimização do tempo para propagar determinada espécie, independente das condições climáticas, além da obtenção de plantas livres de doenças e pragas.
De acordo com Morais et. al. (2017), na cultura de tecidos, são aplicadas técnicas de fitossanidade, como a cultura de meristemas, para a regeneração de plantas sadias através do uso de meristemas apicais e, devido à alta taxa de multiplicação celular e à ausência de feixes vasculares, os meristemas apicais são previamente livres do patógeno.
Alves et al. (2021), apontam que a micropropagação tem sido adotada em muitos países, sendo que no Brasil, esse método vem sendo utilizado de forma crescente nos últimos anos, permitindo assim, um acesso mais ágil dos agricultores a mudas de melhor qualidade. Os autores exemplificam que no processo tradicional de mudas, são necessários doze meses para a obtenção de vinte a trinta mudas, enquanto no processo de micropropagação de mudas, cerca de dez vezes mais mudas são obtidas em quase metade desse tempo.
Segundo Silva e Lacerda e Medeiros (2006), a micropropagação tem sido amplamente aplicada em várias espécies, com resultados positivos tanto em hortaliças, tais quais a batata e cenoura; quanto em plantas ornamentais, como orquídeas, crisântemos e cravos; frutíferas, como abacaxi, morango e banana; medicinais, como ipeca e espinheira santa; e, mais recentemente, em espécies florestais, tais quais pinus e eucalipto.
Conforme Turdiyev (2024), os recursos genéticos vegetais são de grande valor científico e prático, sendo que para preservação de tais recursos, são utilizados juntamente com os métodos tradicionais, os métodos biotecnológicos, que incluem a preservação vegetal em cultura in vitro, através da técnica de micropropagação, sendo que o desenvolvimento de métodos eficazes para micropropagação clonal é condição básica para a criação de banco de genes in vitro.
De acordo Silva (2021), a micropropagação de plantas é uma técnica biotecnológica aplicada à cultura de tecidos vegetais, que pode ser realizada a partir de diversas partes da planta, como sementes, ápices caulinares, segmentos nodais, gemas adventícias e raízes. Esse processo envolve a isolação, esterilização e incubação de células, tecidos e órgãos em um ambiente asséptico, com o objetivo de produzir clones a partir de uma única planta mãe.
De acordo com Alves et al. (2021), a técnica de micropropagação de mudas geralmente envolve o desenvolvimento in vitro de brotos a partir das gemas, que são ápices caulinares ou florais, nos quais são induzidas a formação de novas gemas, em condições controladas de cultivo. Sendo que a velocidade de obtenção de mudas é corroborada pela Embrapa (2024), que afirma a reprodução rápida de plantas com características superiores, possibilitando inclusive, a formação de plantas geneticamente idênticas a partir do cultivo das células da planta matriz.
3 Metodologia
O presente trabalho é uma pesquisa aplicada, que de acordo com Gil (2022), é voltada à aquisição de conhecimentos com intuito de aplicá-los em uma situação específica. Neste caso, teve como objetivo trazer à luz os conhecimentos necessários para a aplicação da técnica de micropropagação de mudas in vitro.
Deste modo, partindo da definição clara do objetivo deste estudo, de forma a subsidiar a fundamentação teórica sobre a temática deste trabalho, foi realizada uma pesquisa bibliográfica que, de acordo com Almeida Júnior (2021), trata-se de uma metodologia eficaz para o levantamento de informações, pois contribui de maneira a oferecer pontos de vista que tornam possíveis as discussões cientificas. Lakatos e Marconi (2021) complementam que a pesquisa bibliográfica tem como base livros, artigos científicos, revistas, dentre outros textos, contudo, predomina o entendimento de que artigos científicos constituem o foco principal dos pesquisadores, uma vez que neles podem ser encontrados conhecimentos científicos atualizados. Assim, foram identificadas as fontes confiáveis, as respectivas localizações e posterior compilação da informação.
Como fontes de pesquisa confiáveis, priorizou-se a utilização de livros e artigos científicos já publicados, relevantes a essa pesquisa, obtidos em bibliotecas digitais e nos endereços eletrônicos dos indexadores científicos Scopus, SciELO e Google Scholar; ao passo que como fontes secundárias e auxiliares, foram obtidas demais publicações digitais a partir da busca com os descritores "micropropagação", "mudas”, “agricultura” e “sustentabilidade” no endereço eletrônico da ferramenta de buscas da Google.
Cabe salientar que como critérios de seleção, foram priorizadas e incluídas as mais recentes publicações científicas encontradas, preferencialmente a partir do ano de 2020, de forma a trazer informações atualizadas dentro da temática proposta por este trabalho de pesquisa. Contudo, não foram descartadas pesquisas importantes anteriormente realizadas ou livros de leitura corrente escritos por autores consagrados no assunto.
Como estratégia de pesquisa, foi utilizada a de Estudo de Caso, que de acordo com Yin (2001), refere-se a uma investigação empírica que examina um fenômeno contemporâneo dentro de seu contexto real, especialmente quando os limites do fenômeno e contexto não estão claramente definidos, podendo ser exploratório, descritivo ou explicativo, com o objetivo a aplicar a técnica apresentada e observar os resultados da implementação de um laboratório de micropropagação de plantas realizado em um viveiro de mudas localizado na cidade de Catalão – GO.
A compreensão das informações obtidas foi realizada através da leitura e interpretação de todo o material encontrado foi realizada por meio da pesquisa anteriormente mencionada e, além disso, foram consideradas as informações obtidas através da análise dos resultados obtidos com a implementação do laboratório no referido viveiro e na simulação computacional da aplicação da técnica em tela para a multiplicação de mudas de bananas.
4 Estudo de caso
De forma a complementar a pesquisa realizada, optou-se pela utilização de um estudo de caso exploratório, que segundo Yin (2001), busca levantar informações preliminares sobre um fenômeno pouco estudado para formular hipóteses futuras, permitindo a coleta de informações que servirão de base para a formulação de cenários e estudos futuros, possibilitando assim, uma compreensão inicial do contexto analisado, identificação de padrões, variáveis relevantes e possíveis relações casuais, o que possibilita uma melhor adequação da técnica para as culturas que são trabalhadas no viveiro escolhido.
Deste modo, o estudo de caso foi realizado em um viveiro de mudas localizado na cidade de Catalão, estado de Goiás, que atualmente enfrenta desafios relacionados à produção em larga escala e está buscando novas formas de produção de mudas que possam agregar valor ao negócio, diversificando suas atividades e ampliando sua competitividade no mercado local, onde as mudas propagadas têm o objetivo de atender os produtores, agricultores e viveiros da região fornecendo mudas de alta qualidade e padronização genética
Assim, inicialmente, este estudo propôs uma intervenção experimental no tocante do planejamento e acompanhamento da implementação de um laboratório básico para aplicação da técnica de micropropagação in vitro no viveiro, como estratégia de inovação tecnológica, visando otimizar o processo de produção de mudas e atender às demandas do mercado com maior qualidade e rapidez.
Diante do exposto, o viveiro já dispunha de uma casa que foi adaptada para funcionar como um laboratório básico, como forma de reduzir os custos de implementação.
Assim, para garantir a funcionalidade do processo de micropropagação, os cômodos da casa foram divididos e equipados com os materiais e equipamentos necessários, conforme disposto nas seções a seguir.
4.1 Sala de lavagem e esterilização
Esta sala é destinada a realizar o descarte de meios de cultura que já foram utilizados e outros resíduos, até que sejam devidamente destinados; sendo também empregada para a lavagem das vidrarias utilizadas, além é claro, de outras atividades gerais.
Estão contidos nessa sala: pias, autoclave, deionizador, geladeira, prateleiras e armários, conforme pode-se observar, de forma panorâmica, na Figura 1.
Figura 1: Sala de lavagem e esterilização

Fonte: Elaborado pelos autores (2025)
Em relação ao deionizador, que pode ser observado na Figura 2, é utilizado para tratar a água, ou seja, para remover íons dissolvido da água e assim garantir um meio com menor risco de contaminação, de forma que nenhuma impureza afete o cultivo in vitro.
Figura 2: Deionizador de água

Fonte: Elaborado pelos autores (2025)
No tocante à autoclave, que pode ser observada na Figura 3, trata-se de um equipamento utilizado para a esterilização do meio de cultura, vidrarias e outros materiais utilizados no ambiente asséptico da câmera de fluxo laminar.
Figura 3: Autoclave

Fonte: Elaborado pelos autores (2025)
4.2 Sala de manipulação asséptica
Nesta sala são realizadas as inoculações e transferências de material genético, além de ser um local onde são preparados meio de culturas e de soluções diversas; estando equipada com capela de fluxo laminar, lamparina a álcool, micro-ondas, pHmetro e balança analítica.
A balança analítica é utilizada para pesar o meio de cultura ou outras soluções com precisão; já o pHmetro é utilizado para ajustar o Ph do meio de cultura; sendo que ambos os equipamentos podem ser observados na Figura 4.
Figura 4: balança e pHmetro

Fonte: Elaborado pelos autores (2025)
A câmara de fluxo laminar, que pode ser observada na Figura 5, é um equipamento utilizado para a manipulação estéril das culturas in vitro, onde o ar é forçado a passar por meio do filtro bacteriológico, criando um ambiente asséptico e evitando a entrada do ar externo contaminado.
Foto 5: Câmara de fluxo laminar

Fonte: Elaborado pelos autores (2025)
4.3 Sala para incubação das culturas
A sala para incubação das culturas, que pode ser observada na Figura 6, tem a função de acondicionar os fracos com as culturas, colocados em estantes dotadas com lâmpadas fluorescentes, até que tais culturas estejam prontas para serem retiradas dos frascos. Cabe salientar que a sala deve possuir um climatizador de ar, de forma a manter a temperatura e umidade rigorosamente controladas.
Figura 6: Sala para incubação das culturas

Fonte: Elaborado pelos autores (2025)
4.4 Casa de vegetação
Ambiente externo do laboratório para aclimatização das plantas após serem retiradas dos frascos, proporcionando condições controladas para a adaptação ao ambiente natural.
4.5 Demais considerações acerca do laboratório
Ademais, além dos equipamentos básicos já citados anteriormente, cabe salientar que o laboratório é dotado pinças, bisturis, tesouras, vidrarias, detergente entre outros utensílios.
4.6 Etapas da implementação da micropropagação
De acordo com Luz et. al. (2024), para o sucesso do cultivo in vitro, vários fatores estão envolvidos, principalmente o tipo de explante, métodos de desinfestação e estabelecimento in vitro, composição do meio de cultura, ambiente de cultura e genótipo, tornando necessário o desenvolvimento de protocolos específicos.
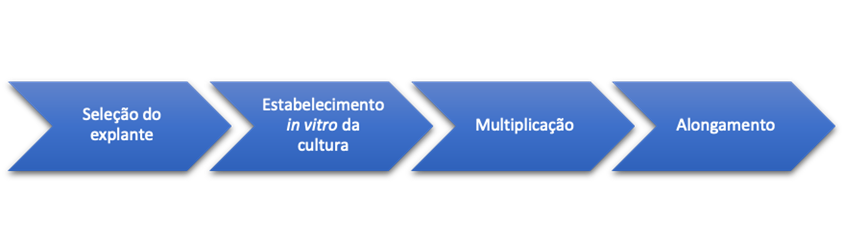
Desta forma, o protocolo especifico adotado neste estudo, deve seguir o caminho metodológico das etapas demonstrada na Figura 7.
Figura 7: Fluxograma de processos
|
|
Fonte: Elaborado pelos autores (2025)
Deste modo, as etapas estão compreendidas em: seleção do explante, estabelecimento in vitro da cultura, multiplicação, alongamento, enraizamento, aclimatação, até obter a muda pronta, conforme veremos de forma detalhada nas próximas subseções.
4.6.1 Seleção do explante
Na seleção do explante, escolheu-se o tipo de material a ser utilizado, sendo que foram utilizados os ápices caulinares, gemas axilares e meristemas devido a sua elevada capacidade de regeneração. O explante foi retirado de plantas matrizes que apresentaram excelente estado fisiológico, nutricional e sanitário, com aparência vigorosa, características essenciais para o sucesso da micropropagação.
Após, foi realizado o processo de desinfestação do explante para eliminação de microrganismos presentes na superfície do explante, com o objetivo de evitar contaminações fúngicas e bacterianas. Esta é uma etapa extremamente importante, pois segundo Cruz et al. (2024), a desinfestação é crucial para o êxito de um protocolo de micropropagação.
Conforme proposto por Cavalcanti et. al. (2007), para higienização e desinfecção, foram utilizados hipoclorito de sódio e outras substâncias com ação germicida, como por exemplo, a imersão em álcool 70% por 3 minutos para quebra de tensão superficial, e logo após, limpeza em hipoclorito de sódio a 20% por 20 minutos.
4.6.2 O estabelecimento in vitro da cultura
Após a desinfestação do explante, foi realizado a sua inoculação em meio de cultura asséptica constituídos de macro e micronutrientes, nitrogênio reduzido, vitaminas, uma fonte de carbono e reguladores de crescimento para garantir a divisão celular, bem como a proliferação dos explantes.
Existem inúmeros meio de cultura e como não há um meio que seja padrão, foi utilizado o meio mais difundido, como o Murashige e Skoog, os quais são conhecidos como meio MS.
4.6.3 Multiplicação
Após alguns dias na fase de estabelecimento, os explantes foram transferidos para a fase de multiplicação, que consiste em diversos ciclos de repicagem. Durante essa fase, os brotos formados foram transferidos para novos frascos contendo novos meios de cultura, com o objetivo de ocorrer novas brotações e, assim, aumentar o número de plantas.
4.6.4 Alongamento, enraizamento e aclimatização
Depois da fase de multiplicação, as brotações resultantes foram individualizadas e transferidas para um novo meio com o objetivo alongar o caule e induzir a formação das raízes. Após a fase de alongamento e a formação de raízes, as plantas precisaram passar pelo processo de climatização como objetivo de adaptá-las progressivamente do ambiente in vitro para as condições climáticas naturais.
5 Resultados e Discussão
No que versa a implementação do laboratório, houve sucesso, sendo os equipamentos básicos instalados corretamente, estando apto para uso. Destarte, dentro do contexto da micropropagação de mudas, após a efetiva implementação do laboratório, foi realizada uma simulação computacional, pois concluímos que a modelagem computacional pode ser uma estratégia eficaz para prever o crescimento de espécies vegetais e fornecer subsídios para o desenvolvimento de protocolos mais eficientes de micropropagação.
Assim, considerando os passos explicados por George (2008, apud Bonnart, Chen e Volk, 2025), pesquisadores mais influentes nesta área, contendo os estágios já apresentados anteriormente, a simulação computacional foi realizada no programa RStudio (2025), em linguagem de programação R, de forma a compreender melhor e criar parâmetros adequados para o início efetivo da aplicação da técnica, otimizados para uso nas plantas cultivadas no viveiro escolhido, sendo elas: orquídeas, bananeiras e amoreiras.
A simulação incorporou variáveis como:
- Número de explantes, que se refere à quantidade de fragmentos vegetais (como brotos, folhas ou pedaços de tecido) colocados inicialmente em meios de cultura para iniciar o processo de micropropagação. Este é o ponto de partida para a multiplicação de mudas. Quanto mais explantes iniciais, maior será o número potencial de mudas geradas ao final do processo, embora também dependa de outros fatores, como taxa de multiplicação e condições ambientais.
- Taxa de multiplicação, que representa o número de novos brotos ou mudas gerados a partir de cada explante a cada subcultivo. Ou seja, é a quantidade de brotos formados por explante em cada ciclo de cultura, sendo um indicador de eficiência do processo.
- Número de subcultivos, que é a quantidade de ciclos que o explante passa em novos meios de cultura durante o processo de micropropagação. Cada subcultivo é uma etapa onde as plantas são transferidas para novos frascos ou recipientes com meios frescos. Quanto mais subcultivos, maior será o número final de mudas produzidas.
- Dias de subcultivos: intervalo de dias entre subcultivos é o período de tempo entre cada ciclo de subcultivo. Este intervalo pode variar dependendo da taxa de crescimento da planta, do tipo de regulador de crescimento usado e das condições ambientais. Este valor determina a frequência que as mudas devem ser transferidas para novos meios de cultura.
- Concentração de reguladores de crescimento (BAP e ANA), onde de acordo com Macêdo (2003), o BAP (6-Benzilaminopurina), é um regulador de crescimento da classe das citocininas, usado para induzir a divisão celular e a formação de brotos. A concentração de BAP é um fator crucial para controlar a multiplicação e o desenvolvimento das plantas in vitro. Já o ANA (Ácido Naftalenoacético) é um regulador de crescimento da classe das auxinas, utilizado para estimular o enraizamento e o desenvolvimento radicular. Assim como o BAP, a concentração de ANA também é crítica para o sucesso da micropropagação.
Assim, a simulação analisou o impacto das diferentes concentrações de reguladores no crescimento e na produtividade das mudas ao longo de múltiplos ciclos de cultivo. Utilizando uma abordagem de simulação estocástica, foram modelados os efeitos das concentrações de BAP e ANA sobre a taxa de multiplicação das plantas, considerando os ciclos mais adequados para cada cultura. Os resultados indicaram que as concentrações de BAP tiveram um efeito positivo na taxa de multiplicação, enquanto o aumento das concentrações de ANA resultou em um controle da formação de brotos.
Para as três culturas, foram testadas diferentes combinações de 4 concentrações de BAP e 4 concentrações de ANA para ver como elas influenciam o crescimento das mudas.
A simulação gerou gráficos que demonstram as variações no crescimento das mudas, proporcionando uma ferramenta útil para otimizar protocolos de cultivo in vitro.
5.1 Simulação de micropropagação em orquídeas
No tocante à simulação do crescimento de mudas de orquídea in vitro, utilizando o modelo citado, foi realizada a simulação de crescimento, utilizando os parâmetros indicados na Tabela 1.
Tabela 1: Parâmetros para cultivo de orquídeas
|
Nº Explantes |
Taxa de multiplicação |
Nº de Subculturas |
|
10 |
1.5 |
10 |
|
|
||
|
Dias de subcultivo |
Concentração BAP |
Concentração ANA |
|
30 |
0.2, 0.5, 0.8, 1.0 mg/L |
0.01, 0.05, 0.1 mg/L |
Fonte: Elaborado pelos autores (2025)
5.1.1 Número de Explantes
Valor utilizado na simulação: 10
Possíveis ajustes: O número inicial de explantes de orquídeas adequado depende do protocolo de cultivo. Normalmente, para orquídeas, inicia-se com 10 a 15 explantes em condições controladas. Sendo assim, foram utilizados 10 explantes para a simulação inicial.
5.1.2 Taxa de Multiplicação
Valor utilizado na simulação: 1,5
Possíveis ajustes: Para orquídeas, a taxa de multiplicação é, em geral, mais baixa do que para outras espécies como bananeiras. A taxa de 1.5 é um bom ponto de partida para orquídeas, já que muitas espécies de orquídeas têm um crescimento mais lento. Pode variar entre 1.2 e 2.0 dependendo da espécie e das condições de cultivo. Sendo assim, foi utilizado a taxa de 1.5 como fator de multiplicação.
5.1.3 Número de subcultivos
Valor utilizado na simulação: 10
Possíveis ajustes: O número de subcultivos para orquídeas pode variar de 6 a 12 subcultivos dependendo da espécie e do protocolo utilizado. Dez subcultivos está dentro do intervalo comum, considerando o tempo necessário para o crescimento inicial e a multiplicação de brotos.
5.1.4 Dias de subcultivos
Valor utilizado na simulação: 30 dias
Possíveis ajustes: O intervalo de 30 dias é o mais comumente utilizado para acelerar o crescimento.
5.1.5 Concentração de BAP (6-Benzilaminopurina)
Valores utilizados na simulação: 0.2, 0.5, 0.8, 1.0 mg/L
Possíveis ajustes: As concentrações de BAP para orquídeas geralmente variam entre 0.2 a 2.0 mg/L, dependendo da espécie e do protocolo. A faixa apresentada está adequada, com a concentração máxima de 1.0 mg/L sendo bem comum em protocolos para orquídeas.
5.1.6 Concentração de ANA (Ácido Naftalenoacético)
Valores utilizados na simulação: 0.01, 0.05, 0.1 mg/L
Possíveis ajustes: O ANA é utilizado para induzir a formação de raízes. As concentrações de ANA para orquídeas são geralmente baixas, e os valores de 0.01 a 0.1 mg/L estão adequados para a maioria dos protocolos de micropropagação de orquídeas. Algumas espécies podem até não precisar de ANA, mas é uma prática comum em muitos protocolos.
Figura 8: Resultado da simulação RStudio - Orquídeas
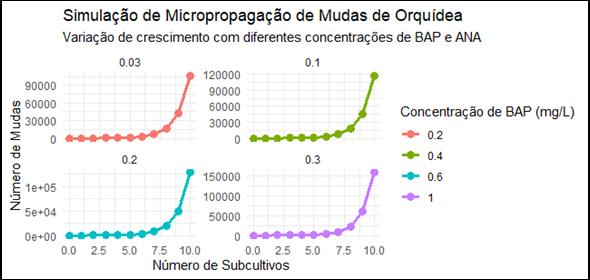
Fonte: Elaborado pelos autores (2025)
5.2 Simulação de micropropagação em bananeiras
No tocante à simulação do crescimento de mudas de bananeiras in vitro, utilizando o modelo citado, foi realizada a simulação de crescimento, utilizando os parâmetros indicados na Tabela 2.
Tabela 2: Parâmetros para cultivo de bananeiras
|
Nº Explantes |
Taxa de multiplicação |
Nº de Subculturas |
|
15 |
4.0 |
8 |
|
|
||
|
Dias de subcultivo |
Concentração BAP |
Concentração ANA |
|
30 |
1.0, 2.0, 2.5, 3.0 mg/L |
0.1, 0.2, 0.3 mg/L |
Fonte: Elaborado pelos autores (2025)
5.2.1 Número de Explantes
Valor utilizado na simulação: 15
Possíveis ajustes: Para bananeiras, o número inicial de explantes pode variar conforme o protocolo de cultivo. Geralmente, trabalha-se com um número inicial entre 10 e 20 explantes, sendo 15 uma escolha adequada para acompanhar a multiplicação ao longo dos subcultivos.
5.2.2 Taxa de Multiplicação
Valor utilizado na simulação: 4.0
Possíveis ajustes: A taxa de multiplicação para bananeiras é geralmente maior do que para outras espécies devido à sua alta capacidade de proliferação in vitro. Valores típicos variam entre 3.0 e 5.0, dependendo do genótipo e das condições do meio de cultura.
5.2.3 Número de subcultivos
Valor utilizado na simulação: 8
Possíveis ajustes: O número de subcultivos pode variar dependendo do tempo necessário para a obtenção de mudas em quantidade suficiente. Para bananeiras, 8 subcultivos é um número adequado para alcançar uma produção eficiente sem comprometer a qualidade das mudas.
5.2.4 Dias de subcultivos
Valor utilizado na simulação: 30
Possíveis ajustes: O intervalo de 30 dias entre subcultivos é comumente utilizado para bananeiras, permitindo uma rápida multiplicação dos brotos e garantindo um alto rendimento no processo de micropropagação.
5.2.5 Concentração de BAP (6-Benzilaminopurina)
Valor utilizado na simulação: 1.0, 2.0, 2.5, 3.0 mg/L
Possíveis ajustes: O BAP é o principal regulador de crescimento utilizado para a multiplicação de brotos em bananeiras. Concentrações entre 1.0 e 3.0 mg/L são eficazes para estimular a formação de gemas laterais sem causar vitrificação ou deformações nas mudas.
5.2.6 Concentração de ANA (Ácido Naftalenoacético)
Valor utilizado na simulação: 0.1, 0.2, 0.3 mg/L
Possíveis ajustes: O ANA é utilizado principalmente na fase de enraizamento, mas concentrações entre 0.1 e 0.3 mg/L podem ser aplicadas durante a fase de multiplicação para equilibrar o desenvolvimento radicular e a formação de brotos.
Figura 9: Resultado da simulação RStudio - Bananeira
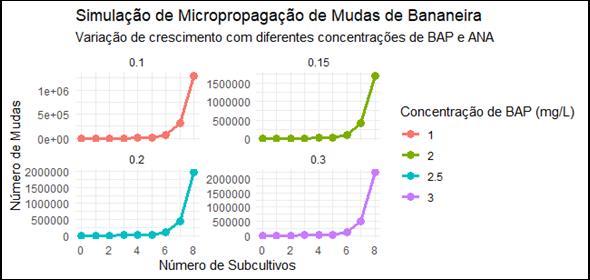
Fonte: Elaborado pelos autores (2025)
5.3 Simulação de micropropagação em amoras
No tocante à simulação do crescimento de mudas de amoreiras in vitro, utilizando o modelo citado, foi realizada a simulação de crescimento, utilizando os parâmetros indicados na Tabela 3.
Tabela 3: Parâmetros para cultivo de bananeiras
|
Nº Explantes |
Taxa de multiplicação |
Nº de Subculturas |
|
10 |
2.5 |
10 |
|
|
||
|
Dias de subcultivo |
Concentração BAP |
Concentração ANA |
|
45 |
0.2, 0.4, 0.6, 1.0 mg/L |
0.1, 0.2, 0.3 mg/L |
Fonte: Elaborado pelos autores (2025)
5.3.1 Número de Explantes
Valor utilizado na simulação: 10
Possíveis ajustes: O número inicial de explantes pode variar dependendo do protocolo de cultivo. Para amoras, 10 explantes é um valor adequado para uma simulação inicial, permitindo acompanhar a multiplicação ao longo dos subcultivos.
5.3.2 Taxa de Multiplicação
Valor utilizado na simulação: 2.5
Possíveis ajustes: Para amoras, a taxa de multiplicação é geralmente mais alta do que para orquídeas, pois essas plantas apresentam um crescimento mais vigoroso in vitro. A taxa de 2.5 representa um crescimento significativo e pode variar entre 2.0 e 3.5 dependendo das condições de cultivo e do genótipo.
5.3.3 Número de subcultivos
Valor utilizado na simulação: 10
Possíveis ajustes: O número de subcultivos pode variar conforme a espécie e o protocolo utilizado. No caso das amoras, 10 subcultivos permitem avaliar o desenvolvimento das mudas ao longo do tempo e sua resposta às diferentes concentrações de reguladores de crescimento.
5.3.4 Dias de subcultivos
Valor utilizado na simulação: 45
Possíveis ajustes: O intervalo de 45 dias entre os subcultivos é adequado para amoras, permitindo um tempo suficiente para a regeneração e proliferação dos brotos.
5.3.5 Concentração de BAP (6-Benzilaminopurina)
Valores utilizados na simulação: 0.2, 0.4, 0.6, 1.0 mg/L
Possíveis ajustes: As concentrações de BAP para micropropagação de amoras geralmente variam entre 0.2 e 2.0 mg/L. A faixa escolhida está dentro dos valores comumente utilizados para promover a multiplicação de brotos sem causar efeitos adversos, como hiperidricidade.
5.3.6 Concentração de ANA (Ácido Naftalenoacético)
Valor utilizados na simulaçãos: 0.03, 0.1, 0.2, 0.3 mg/L
Possíveis ajustes: O ANA é utilizado para induzir o enraizamento das mudas. Para amoras, concentrações entre 0.03 e 0.3 mg/L são adequadas para estimular a formação de raízes sem inibir o crescimento dos brotos.
Figura 10: Resultado da simulação RStudio - Amoreira
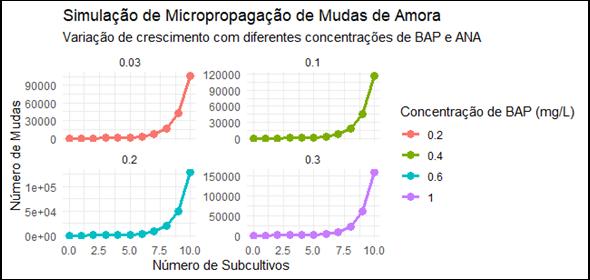
Fonte: Elaborado pelos autores (2025)
6 Considerações finais
O uso do programa RStudio (2025) possibilitou emular diversos cenários, poupando tempo e recursos. Os resultados obtidos neste estudo demonstram que a micropropagação de mudas in vitro é uma técnica eficiente e viável para a produção em larga escala de plantas de alta qualidade. A utilização de reguladores de crescimento vegetal mostrou-se fundamental para a obtenção de plântulas vigorosas, com alta taxa de sobrevivência e bom desempenho no processo de aclimatação.
A combinação de BAP e ANA se destacou como um protocolo eficiente para estimular a multiplicação e o enraizamento das mudas, proporcionando taxas de sucesso superiores às descritas na literatura. Além disso, o uso de substratos mistos na fase de aclimatação revelou-se uma estratégia eficaz para garantir a adaptação das plântulas ao ambiente ex vitro, favorecendo o crescimento saudável e o estabelecimento das plantas no campo.
A alta taxa de multiplicação das mudas micropropagadas confirma a estabilidade fisiológica das plantas, evidenciando a aplicabilidade da técnica para a produção comercial de mudas. Dessa forma, este estudo contribui para o aprimoramento dos protocolos de micropropagação, fornecendo subsídios para a produção sustentável e econômica de mudas.
Dessa forma, este estudo contribui para o aprimoramento dos protocolos de micropropagação, fornecendo subsídios para a produção de mudas de forma a proporcionar uma gestão sustentável e economicamente viável, sobretudo no contexto de uma agricultura moderna comprometida com práticas ambientalmente responsáveis.
Entretanto, recomenda-se a realização de novos estudos para a otimização dos protocolos utilizados, especialmente no que se refere ao controle de hiperidricidade e ao aprimoramento das condições de aclimatação. Pesquisas futuras também poderão explorar a viabilidade econômica da técnica e sua aplicação para outras variedades de orquídeas, bananeiras e amoreiras, ampliando seu potencial de uso na agricultura.
Por fim, este trabalho reforça a importância da micropropagação in vitro como uma ferramenta essencial para a propagação rápida e eficiente de mudas de banana, contribuindo para o avanço do setor agrícola e o desenvolvimento de práticas sustentáveis de cultivo.
7 Agradecimentos
Agradecemos ao Instituto Federal de Educação, Ciência e Tecnologia de Minas Gerais (IFMG), Campus Bambuí, em especial ao Programa de Pós-Graduação Lato Sensu em Gestão, por possibilitar aos autores a oportunidade de estudo e aprofundamento de técnicas de inovação tecnológica, aos professores titulares da referida instituição que com dedicação nos transmitiram inúmeros conhecimentos, os quais guardaremos e aplicaremos por toda a vida e ao nosso querido orientador, Prof. Doutor Plinio Alexandre dos Santos Caetano, que com extrema dedicação e paciência, nos orientou de forma a atingirmos nosso grande objetivo, bem como a todos os que de alguma forma contribuíram para a realização desta pesquisa.
Referências bibliográficas
ALMEIDA JÚNIOR, João Baptista de. O estudo como forma de pesquisa. In: CARVALHO, Maria Cecília. M. C (org.). Construindo o Saber: Metodologia Científica - Fundamentos e Técnicas. 1. ed. Campinas: Papirus, 2021. p. 119-146.
ALVES, Rafael Ribeiro. ESG: O presente e o futuro das empresas. 1. ed. Petrópolis: Vozes, 2023.
ALVES, Élio José. et al. Mudas Micropropagadas. Embrapa, 8 dez. 2021. Disponível em: https://www.embrapa.br/agencia-de-informacao-tecnologica/cultivos/banana/producao/propagacao/micropropagadas#:~:text=Al%C3%A9m%20da%20produ%C3%A7%C3%A3o%20de%20mudas,obten%C3%A7%C3%A3o%20de%20plantas%20com%20caracter%C3%ADsticas. Acesso em 17 ago. 2024.
BONNART, Remi; CHEN Katheryn; VOLK, Gayle. M. Plant Tissue Culture Media Preparation. Colorado State University, 2025. Disponível em: https://colostate-pressbooks-pub.translate.goog/clonalcryopreservation/chapter/media/?_x_tr_sl=en&_x_tr_tl=pt&_x_tr_hl=pt&_x_tr_pto=tc. Acesso em 02 fev. 2025.
CARVALHO, Julita Maria Frota Chagas; SILVA, Marina Medeiros de Araújo; LACERDA E MEDEIROS, Maria Jaislanny. Fatores inerentes à micropropagação. Campina Grande: Embrapa, 2006. p. 11-25. (Documentos, 148). Disponível em: https://www.infoteca.cnptia.embrapa.br/bitstream/doc/276578/1/DOC148.pdf. Acesso em 13 mai. 2025.
CAVALCANTI, Thaís Silva. et al. Estabelecimento de condições para cultivo e floração de plantas in vitro, visando à sua comercialização direta. Ornamental Horticulture, v. 13, n. 1, p. 9–14, 2007. Disponível em: https://ornamentalhorticulture.com.br/rbho/article/view/1636/1181. Acesso em: 29 jan. 2025.
LUZ, Suelen Caroline dos Santos da. et al. Diferentes tratamentos de desinfestação in vitro na micropropagação de segmentos nodais de Ocotea odorifera (Vell.) Rohwer (canela-sassafrás). Revista Delos, v. 17, n. 54, p. e1411, 2024. DOI: 10.55905/rdelosv17.n54-025. Disponível em: https://ojs.revistadelos.com/ojs/index.php/delos/article/view/1411. Acesso em: 12 maio. 2025.
DIAS, Carlos Magno Corrêa. Inovação gerando ondas de inovação. Federação Nacional dos Engenheiros, 28 fev. 2024. Disponível em https://www.fne.org.br/index.php/artigos/7048-artigo-inovacao-gerando-ondas-de-inovacao. Acesso em: 6 set. 2024
EMBRAPA. Biotecnologia. 2024. Disponível em https://www.embrapa.br/contando-ciencia/biotecnologia/-/asset_publisher/wNet9XcMlLFn/content/micropropagacao-de-plantas/1355746?inheritRedirect=false. Acesso em: 17 abr. 2024
KNEIPP, Jordana Marques. et al. Práticas de inovação orientadas para a sustentabilidade: transformando modelos de negócios industriais. Revista Gestão & Sustentabilidade, v. 6, n. 1, p. e14367, 20 mai. 2024. Disponível em https://doi.org/10.36661/2596-142X.2024v6n1.14367. Acesso em: 6 set. 2024
FOOD CONECTION. Agricultura sustentável e produção de alimentos: como sua indústria ganha valor agregado com este tema. 6 abr. 2023. Disponível em https://www.foodconnection.com.br/artigos/agricultura-sustentavel-e-producao-de-alimentos-como-sua-industria-ganha-valor/. Acesso em: 05 fev. 2025
GIL, Antônio Carlos. Como elaborar projetos de pesquisa. 7. ed. São Paulo: Atlas, 2022.
HUSSAIN, Altaf. et al. Plant tissue culture: current status and opportunities. In: LEVA, Annarita; RINALDI, Laura M. (Org.). Recent advances in plant in vitro culture. Rijeka: InTech, 10 mai. 2012. p. 1-28. Disponível em: https://www.intechopen.com/chapters/40180. Acesso em 13 mai. 2025.
LAKATOS, Eva Maria; MARCONI, Marina de Andrade. Fundamentos de Metodologia Científica. 9. ed. São Paulo: Atlas, 2021.
LUZ, Suelen Caroline dos Santos. et.al. Diferentes tratamentos de desinfestação in vitro na micropropagação de segmentos nodais de Ocotea odorifera (Vell.) Rohwer (canela-sassafrás). Revista Delos, [s. I.], v. 17, n. 54, p. e1411, 24 abr. 2024. DOI: 10.55905/rdelosv17.n54-025. Disponível em: https://ojs.revistadelos.com/ojs/index.php/delos/article/view/1411. Acesso em: 12 maio. 2025
MACÊDO, C. E. C. de. et al. Concentrações de ANA e BAP na micropropagação de abacaxizeiro L. Merrill (Ananas comosus) e no cultivo hidropônico das plântulas obtidas in vitro. Revista Brasileira de Fruticultura, v. 25, n. 3, p. 501–504, dez. 2003. Disponível em: https://www.scielo.br/j/rbf/a/BB7dbVmFRSVdjG7m3WbT4zP/. Acesso em 02 mar 2025.
MINISTÉRIO DO DESENVOLVIMENTO E ASSISTÊNCIA SOCIAL, FAMÍLIA E COMBATE À FOME. Transformando nosso mundo: a agenda 2030 para o desenvolvimento sustentável. 2024. Disponível em: https://www.mds.gov.br/webarquivos/publicacao/Brasil_Amigo_Pesso_Idosa/Agenda2030.pdf. Acesso em: 12 set. 2024
MORAIS, Emerson Rodrigues de. et al. Micropropagação da Cana-de-Açúcar. Colloquium Agrariae, vol. 13, n. Especial, Jan–Jun, 2017, p. 322-338. DOI: 10.5747/ca.2017.v13.nesp.000237. Disponível em: https://journal.unoeste.br/suplementos/agrariae/vol13nr2/MICROPROPAGA%C3%87%C3%83O%20DA%20CANA-DE-A%C3%87%C3%9ACAR.pdf. Acesso em 12 mai. 2025.
MOURA, Luiz Antonio Abdalla de. Qualidade e Gestão Ambiental: Sustentabilidade e ISO 14001. 7. ed. Rio de Janeiro: Freitas Bastos, 2023.
ORGANIZAÇÃO DAS NAÇÕES UNIDAS. ONU: 43,2 milhões de pessoas sofrem de fome na América Latina e no Caribe. 9 nov. 2023. Disponível em https://brasil.un.org/pt-br/252299-onu-432-milh%C3%B5es-de-pessoas-sofrem-de-fome-na-am%C3%A9rica-latina-e-no-caribe. Acesso em: 29 jan. 2025
ORGANIZAÇÃO DAS NAÇÕES UNIDAS. Objetivos de Desenvolvimento Sustentável: 2 – Fome zero e agricultura sustentável. 2024. Disponível em https://brasil.un.org/pt-br/sdgs/12. Acesso em: 17 ago. 2024
ORGANIZAÇÃO DAS NAÇÕES UNIDAS. Objetivos de Desenvolvimento Sustentável: 12 – Consumo e produção responsável. 2024. Disponível em https://brasil.un.org/pt-br/sdgs/12. Acesso em: 17 ago. 2024
RSTUDIO. RStudio: ambiente de desenvolvimento integrado para R. Versão 2023.03.0.250. Boston, 2023. Disponível em: https://www.rstudio.com/. Acesso em: 2 mar. 2025.
SILVA, Arthur Luiz Lourenço da. Inovação tecnológica: Principais técnicas da Micropropagação de Plantas. Biotec Oportunidades. 8 jun. 2021. Disponível em https://www.linkedin.com/pulse/inova%C3%A7%C3%A3o-tecnol%C3%B3gica-principais-t%C3%A9cnicas-da-de-biotec-oportunidades/. Acesso em: 17 ago. 2024
TURDIYEV, T. et al. Micropropagation of berry crops for creation of germplasm cryobanks. Brazilian Journal of Biologia, Brasil, v. 84, p. e266975, 2024. Disponível em https://doi.org/10.1590/1519-6984.266975. Acesso em: 17 ago. 2024
YIN, Robert. K. Estudo de caso: Planejamento e Métodos. Tradução de Daniel Grassi. 2 ed. Porto Alegre: Bookman, 2001.